ISTRAŽIVANJA
Prof. dr Ljubiša Topisirević
U kontaktu sa antibioticima
Bakterije i poslednja reč
Po svome načinu delovanja antibiotici se grupišu u bakteriostatičke i baktericidne antibiotike. U bakteriostatičke antibiotike spadaju, npr. tetraciklini, eritromicin i hloramfenikol. Oni ostvaruju svoje delovanje tako što sprečavaju rast, deobu bakterija - ali in ne ubijaju. Tetraciklini i eritromicin to čine sprečavajem sinteze proteina, koji su neophodni za sve funkcije u bakterijskoj ćeliji. To je razlog za- što imuni sistem čoveka mora biti efikasan da bi bakterije kojima su ovi antibiotici sprečili rast, a još su žive, bile eliminisane iz organizma. Za razliku od njih, baktericidni antibiotici ubijaju bakterije.
U ovu grupu antibiotika spadaju b-laktamski antibiotici (penicilini, cefalosporini, karbapenemi) i aminoglikozidi (streptomicin, neomicin, kanamicin, garamicin). Tako je, na primer, za efikasno delovanje penicilina i cefalosporina potrebna intenzivna deoba ćelija. Razlog za to je mehanizam delovanja b-laktama koji se zasniva na inhibiciji sinteze peptidoglikana (sastavna komponenta zida bakterijske ćelije) što izaziva lizu, smrt bakterija.
Antibiotska era je počela 40-tih godina 20. veka, kada su počeli da se koriste penicilin i streptomicin za tretman patogenih bakterija. Sledećih 20 godina je faza intenzivnog otkrića novih antibiotika (grupa b-laktamskih antibiotika, grupa aminoglikozida, tetraciklini, eritromicin, hloramfenikol i dr.) od kojih se i danas veliki broj koristi.

Tolerancija
Široko korišćenje antibiotika je relativno brzo izazvalo reakciju bakterija i počeli su se registrovati rezistentni sojevi raznih bakterija na koje antibiotik više nije delovao. Na primer, korišćenje penicilina je po- čelo 1943. godine, a rezistentni mutanti su se pojavili 1946. godine. Rezistencija bakterije Staphylococcus aureus na antibiotik meticilin je registrovana nakon samo jedne godine posle početka njegove upotrebe.
To je stimulisalo proizvodnju semisintetskih antibiotika, kao što je b-laktamski antibiotik ampicilin, koji je počeo da se koristi 1961. godine. Međutim, rezistentni mutanti na ampicilin su se pojavili posle 12 godina njegove upotrebe. Da bi se razumela strategija razvoja rezistencije u bakterija, počela su intenzivna istraživanja molekularnih mehanizama rezistencije, odnosno na koji način bakterija preživljava delovanje antibiotika. Istraživanja su pokazala da bakterije poseduju različite modalitete vezane za odbranu od delovanja antibiotika. Jedan način je urođeni fenomen bakterija nazvan tolerancija.
Ona se generalno shvata kao sposobnost bakterijske populacije da preživi privremeno, kratkotrajno izlaganje tretmanu i to baktericidnim antibioticima. Razlog za to je što najveći broj bakterija preživljava kratkotrajno izlaganje bakteriostatičkim antibioticima pošto oni samo zaustavljaju rast a ne ubijaju bakterije, za razliku od baktericidnih antibiotika.
Stoga je produženi tretman, pre nego visoka koncentracija antibiotika, potreban da se ispolji povoljan efekat njihovog delovanja na tolerantne bakterije. U vezi stim, uveden je pojam minimalno vreme za ubijanje bakterija (MDK; „minimum duration for killing”). To je vreme za koje tretman antibiotikom eliminiše najveći deo populacije bakterija (npr. 99%). Vrednost MDK se razlikuje medju bakterijama i koristi se za definisanje stepena tolerancije na antibiotik.
Rezistencija
Rezistencija objašnjava naslednu osobinu bakterija da rastu u prisustvu visokih koncentracija antibiotika bez obzira na dužinu tretmana antibiotikom (rezistentni mutanti bakterija). Rezistentne bakterije poseduju razne molekularne mehanizme kojima sprečavaju da se antibiotik veže za neki od molekula u ćeliji, vitalnih za njeno funkcionisanje, te antibiotik ne može da deluje na te bakterija. Streptomicin i ostali aminoglikozidi ostvaruju svoj efekat na bakteriju tako što se vežu za ribozom (struktura koja je odgovorna za sintezu proteina), te se obustavlja sinteza proteina koji su i gradivni i funkcionalni elementi ćelije.
Bakterije ostvaruju rezistenciju na streptomicin mutacijom koja dovodi do izmene mesta na ribozomu za koje se antibiotik veže. Rezistencija na tetraciklin, koji takođe inhibira sintezu proteina, zasniva se na sposobnosti mutanata da ispumpavaju tetraciklin iz ćelije. Na taj način antibiotik ne može da dostigne koncentraciju u ćeliji potrebnu da ubije bakteriju. Mnoge bakterije poseduju mehanizam inaktivacije antibiotika njegovim razlaganjem ili modifikacijom. Bakterije rezistentne na penicilin ili cefalosporin sintetišu enzim b-laktamazu koja razlaže strukturu antibiotika (b-laktamski prsten) odgovornu za njihovo delovanje.
Štaviše, rezistentne bakterije izbacuju enzim b-laktamazu koja razlaže antibiotik van ćelije u sredinu u kojoj rastu. Na taj način se koncentracija penicilina ili cefalosporina smanjuje u okolini, tako da i senzitivne bakterije imaju šansu da prežive tretman (princip „dok jedni rade, a ostali uživaju”). U slučaju modifikacije, antibiotik ulazi u bakteriju i u njoj biva hemijski modifikovan, odnosno na aktivni deo antibiotika se veže neki molekul iz ćelije (npr. fosforna ili acetilna grupa, princip „svako gleda samo sebe”). Stepen rezistencije na antibiotike se definiše minimalnom inhibitornom koncentracijom (MIC). MIC predstavlja najmanju koncentraciju antibiotika u kojoj se, posle 24 ili 48 h inkubacije u optimalnim uslovima, ne registruje rast bakterija. Slično kao MDK, vrednost MIC definiše stepen rezistencije bakterije na antibiotike.
KOMBINACIJA ANTIBIOTIKA
Dosadašnje iskustvo korišćenja antibiotika govori da bakterije imaju poslednju reč! Stoga je potrebno da se drasti no promeni strategija tretmana antibioticima, kako bismo eliminisali eventualno vraćanje u preantibiotsku eru.
Jedan od pristupa je koriščenje kombinacije antibiotika u tretmanu pacijenata. Pozitivni efekti kliničkog korišćenja kombinacije antibiotika bi bili sprečavanje pojave rezistentnih bakterija. Takvim tretmanom se drastično smanjuje verovatnoća nastanka bakterija koje su istovremeno rezistentne na oba antibiotika nego na svakog pojedinačno. S druge strane, smanjio bi se toksični efekat antibiotika pošto bi se mogli koristiti u manjim koncentracijama ponaosob za tretman, pogotovu ako kombinacija ima sinergistički efekat delovanja na bakterije. Kombinacija antibiotika bi mogla biti efikasnija u tretmanu istovremene infekcije sa više različitih bakterija. Na kraju, ali ne po važnosti, opšte je mišljenje među naučnicima koji se bave izučavanjem mehanizama nastanka rezistencije u bakterija da je potrebno uraditi sledeće: uvesti striktnu kontrolu prometa antibiotika, uvesti edukaciju o efektima antibiotika u lečenju lekara koji ih prepisuju i sprovesti edukaciju pacijenata na koji način da ih koriste.
Eksperiment dr Bigera
Nasuprot rezistenciji i toleranciji, koje su karakteristika cele bakterijske populacije, perzistencija je sposobnost brojčano malog dela populacije normalnih bakterija senzitivnih na antibiotike (najčešće manje od 1%) da prežive izlaganje visokoj koncentraciji antibiotika. Perzistencija se tipično uočava kada najveći deo bakterijske populacije biva brzo ubijen antibiotikom dok ova subpopulacija ostaje živa u mnogo dužem vremenskom periodu.
Perzistentne bakterije spontano ulaze u neaktivno, dormantno stanje i prestaju sa deobom. Kada se populacija bakterija tretira baktericidnim antibioticima, bakterije koje su u punoj fiziološkoj aktivnosti bivaju ubijene dok perzistentne bakterije preživljavaju tretman. Ulazak bakterija u perzistenciju izazivaju stresna stanja kao što su nedostatak nutrijenata, hraniva potrebnih za rast bakterija, sniženje optimalne temperature na kojoj bakterija raste, faktori domaćina (čovek ili životinja) u kojima se patogena bakterija razmnožava kao i sam tretman antibioticima. Perzistentne bakterije igraju glavnu ulogu u nepristupačnosti hroničnih infekcija lečenju antibioticima.
One su otkrivene 1944. godine, ali se tek sada shvataju mehanizami njihovog formiranja. Pomenute godine, dr Joseph Bigger, lekar sa Univerziteta u Dablinu, radio je eksperimente sa penicilinom koji se u to vreme pojavio kao novo sredstvo za tretman bakterija. Dodavao je penicillin u kulturu bakterije Staphilococcus aureus i registrovao da dolazi do lize bakterija, jer je dobijao „bistru” kulturu. Da bi proverio da li su sve bakterije u tretiranoj kulturi ubijene penicilinom, on je uzeo uzorak „bistre” kulture i zasejao ga na podlogu na kojoj stafilokokus raste. Nakon inkubacije u optimalnim uslovima za njegov rast, dobio je veoma mali broj kolonija bakterija koje su preživele tretman penicilinom. U ponovljenom eksperimentu, koriste i preživele bakterije, konstatovao je da one u prisustvu penicilina liziraju na identičan način kao i polazne bakterije. Ovu malu subpopulaciju bakterija dr Bigger je nazvao „perzistentne” bakterije da bi ih razlikovao od rezistentnih bakterija.

Širenje rezistencije
Zašto postoji tolika razlika između značaja veoma starog problema perzistencije i sporog napretka u njegovom razumevanju? Razlog za to je što su veoma brzo posle uvođenja penicilina u praksu detektovane patogene bakterije rezistentne na penicilin. U njima je detektovan enzim b-laktamaza, koji razlaže penicilin, te rezistentna bakterija može da raste u njegovom prisustvu.
Širenje rezistencije na antibiotike patogenih bakterija zapretilo je da će ugroziti efikasnost antibiotika u lečenju tako da su istraživanja na mehanizama rezistencije dobila apsolutni prioritet a za istraživanja fenomena perzistentnih bakterija izgubio se interes. Zlatna era otkrića antibiotika je bila od 1940tih do 1960tih godina, kada su u praksu uvedeni penicilin, streptomicin, eritromicin i tetraciklin, koji se još uvek koriste. Međutim, sve je veći broj različitih bakterija koje su postale rezistentne na antibiotike.
Štaviše, mnoge od njih su postale multipno rezistentne, odnosno istovremeno su rezistentne na više atibiotika. Taj fenomem predstavlja izuzetan problem. Da li se savremena civilizacija vraća u preantibiotsku eru? Devedesetih godina prošlog veka, postalo je jasno da je prognozirana pobeda nad patogenim bakterijama korišćenjem antibiotika bila iluzija, s obzirom da se rezistencija na antibiotike širila brže nego proces otkrivanja novih antibiotika.
Uloga biofilma
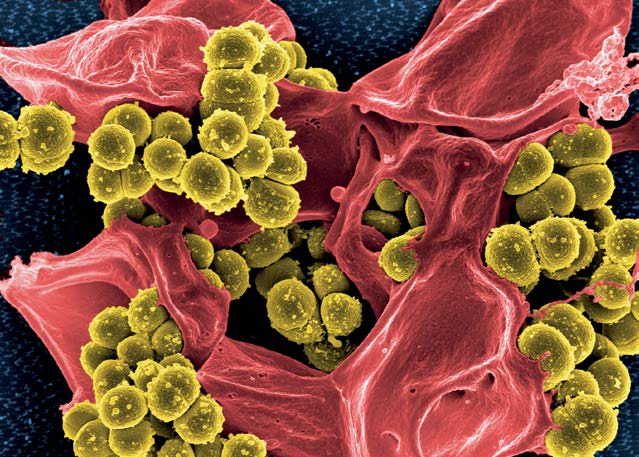
Neadekvatno i nekontrolisano korišćenje antibiotika doprinelo je, svakako, povećanju broja rezistentnih bakterija. S druge strane, pored akutnih infekcija izazvanih bakterijama, broj slučajeva hroničnih infekcija je rastao usled povećanja broja imunokompromitovanih pacijenata zbog hemoterapije raka i side. Istraživanja su pokazala da su mnoge hronične infekcije povezane sa sposobnošću patogenih bakterija da formiraju biofilm (višeslojna struktura bakterija) (Slika 1). Formiranje biofilmova je povezano sa velikim brojem bakterijskih infekcija (gingivitis, endokarditis, cistitis, infekcija urinarnog sistema, cistič- na fibroza i dr.) koje predstavljaju veliki problem u kliničkoj medicini. Testiranje efekta antibiotika na biofilmove raznih vrsta bakterija pokazalo je iznenađujuću sposobnost bakterija koje formiraju biofilm da prežive tretman antibioticima i ako ne poseduju klasičan mehanizm rezistencije.
Štaviše, u ovakvom stanju bakterije pokazuju multipnu rezistenciju na antibiotike. U izučavanju, na primer, efekta različitih doza antibiotika na biofilm bakterije Pseudomonas aeruginosa, pokazalo je da je u biofilmu prisustna jako mala subpopulacija bakterija koja nema bilo kakvu genetičku promenu u poređenju sa senzitivnim bakterijama. Ta subpopulacija predstavlja perzistentne bakterije koje preživljavaju tretman i visokim dozama antibiotika. Slični rezultati su dobijeni i u eksperimentima sa ostalim bakterijama (Escherichia coli, Mycobacterium tuberculosis, Staphylococcus aureus).
Ovi rezultati su ponovo pokrenuli izučavanje perzistencije patogenih bakterija, jer su one najverovatnije uzrok nemogućnosti tretmana hroničnih bakterijskih infekcija antibioticima. Napredak u proučavanju perzistencije u poslednjoj deceniji doveo je do spoznaje da su perzistentne bakterije „uspavane” ćelije u biofilmu, odnosno bakterije koje imaju izuzetno smanjenu metaboličku aktivnost. U takvom stanju antibiotici ne deluju na njih. U eksperimentima u kojima su biofilmovi bakterija bili sukcesivno izlagani visokim dozama baktericidnih antibiotika, rezultat je bio selekcija sve većeg broja perzistentnih ćelija. To se dešava i kada se pacijenti sa hroničnim infekcijama periodično tretiraju na isti način. Kada se tretman antibioticima završi, perzistentne ćelije obnavljuju populaciju i to je osnovni problem u tretmanu hroničnih infekcija.
Čišćenje proteinskog „đubreta”
U nezavisnim istraživanjima načina kako bakterije obezbeđuju kontrolu kvaliteta proteina u ćeliji, da bi normalno funkcionisale, otkriveno je da poseduju familiju specifičnih alatki, enzima (Clp proteaze). Ovi enzimi omogućavaju da bakterija efikasno eliminiše „đubre” iz ćelije, odnosno deformisane proteine koji su izgubili funkciju, uz utrošak energije.
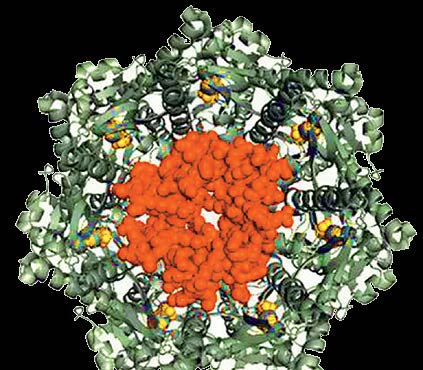
Ove proteaze su veoma složene građe i sastoje se od dva tipa gradivnih elemenata. Ti elementi grade dve prstenaste strukture sa malim otvorima, koje su locirane jedna iznad druge tako da formiraju uzan kanal (Slika 2A). Kada deformisan protein bude prepoznat od Clp proteaze, gornji prsten ga ubacuje u kanal i prebacije do donjeg prstena koji ga razgrađuje.
Na taj način bakterija eliminiše proteinsko „đubre” iz ćelije. Međutim, „đubretar” Clp proteaza uopšte ne prepoznaje funkcionalne, normalne proteine, te bakterija može da normalno raste i da se razmnožava bez gomilanja „đubreta”. Na osnovu ovih rezultata, postavilo se pitanje: da li bi mogao da se nađe neki antibiotik koji bi poremetio aktivnost Clp proteaze?
Odnosno, da vezivanje takvog antibiotika za Clp proteazu izazove da ona počne da razgrađuje i normalne proteine neophodne za opštu funkciju i rast bakterije? To bi za posledicu trebalo da ima i ubijanje perzistenzih bakterija. Ovakva strategija za borbu protiv perzistentnih bakterija nastala je kada je otkriveno da mali molekuli, acildepsipeptidi (ADEP), narušavaju preciznost Clp proteaze tako da ona počinje da degradira i normalne proteine ćelije. Acildepsipeptidi su nova familija prirodnih antibiotika koje sintetiše bakterija Streptomyces hawaiiensis
Na modelu miša
Mehanizam delovanja ADEP je jedinstven. Ustanovljeno je da ADEP otvaraju i proširuju kanal Clp proteaza raznih bakterija (Slika 2B). Posledica je da, ovaj inače uzan i veoma selektivan kanal kada se ADEP ve- že za Clp proteazu, ona počinje da degradira veliki broj funkcionalnih proteina bez kojih bakterija ne može da raste, što izaziva njeno ubijanje. Da li ovi antibiotici imaju efekta i na bakterije koje su u stacionarnoj fazi, odnosno koje se ne dele?
Da li deluju na perzistentne bakterije koje su u dormantnom stanju? Realizovan je eksperiment gde su ćelije u stacionarnoj fazi meticilin-rezistentne bakterije Staphylococcus aureus (MRSA) tretirane 24 h sa mnogo jačim sintetičkim derivatom ADEP-a (ADEP4). Nakon analize proteoma (ukupni proteini bakterije) netretiranih i antibiotikom tretiranih ćelija, otkriveno je da je od 1712 proteina detektovanih u netretiranim elijama, 417 proteina razgrađeno u tretiranim ćelijama. Među razgrađenim proteinima je veliki broj onih bez kojih bakterija ne može da funkcioniše, kao što su npr. enzimi uključeni u sintezu zida pri deobi ćelija.
Pored toga, nađeno je da, kada se ADEP4 veže za Clp proteazu, više nije potrebna energija za njenu aktivnost. To otvara mogućnost delovanja ovog antibiotika na perzistentne bakterije koje imaju veoma nizak energetski nivo. Izuzetno dobri rezultati su dobijeni kada je hronična infekcija na modelu miša, izazvana biofilmom bakterije Staphylococcus aureus, tretirana kombinacijom antibiotika ADEP4 i rifampicina. Hronična infekcija je eliminisana. Novi derivati ADEP-a sa povećanom antibakterijskom aktivnošću su sintetisani. Međutim, imajući loše iskustvo sa dosadašnjim korišćenjem antibiotika, uključujući razvoj rezistencije i sporednih efekata na pacijenta za apsolutnu sigurnost korišćenja ovih derivata u terapiji, potrebna su dodatna istraživanja.
Prof. dr Ljubiša Topisirević
Kompletni tekstove sa slikama i prilozima potražite u magazinu
"PLANETA" - štampano izdanje ili u ON LINE prodaji Elektronskog izdanja
"Novinarnica"
|

