OTKRIĆA
Pripremio: Prof. dr Branislav Čabrić
Voda
Bez H2O?
Voda je najpoznatije, a verovatno i najvažnije hemijsko jedinjenje. Međutim, u poređenju sa drugim tečnostima, voda je veoma neobična supstanca. Uočeno je čak četrdeset neobičnih ("anomalnih") osobina koje vodu razlikuju od velike većine drugih tečnosti. Predložen je veći broj različitih teorijskih modela za vodu. Ovi modeli imaju zadatak da, ako ne kvantitativno, onda makar kvalitativno objasne sve one pojave koje se nazivaju “anomalnim ponašanjem” vode.
 Opšte su poznate osnovne osobine vode: da se mrzne na 0 o C , da (na atmosferskom pritisku) ključa na 100 o C, i da je led lakši (tačnije: ima manju gustinu) od tečne vode. Svako iole školovan zna da je formula vode H 2 O. Opšte su poznate osnovne osobine vode: da se mrzne na 0 o C , da (na atmosferskom pritisku) ključa na 100 o C, i da je led lakši (tačnije: ima manju gustinu) od tečne vode. Svako iole školovan zna da je formula vode H 2 O.
Voda je, međutim, u poređenju sa drugim tečnostima, veoma neobična supstanca. Učenijim jezikom se kaže da voda poseduje niz anomalnih osobina. O čemu se radi?
Visoka tačka ključanja
Molekuli u tečnosti su, usled međusobnih privlačnih sila, prilepljeni jedni za druge. Tačka ključanja predstavlja temperaturu na kojoj je kinetička energija čestica dovoljno velika da savlada ove privlačne sile i omogući da se molekuli odvoje jedni od drugih i odlete u okolni prostor (u obliku gasa).
Voda je jedinjenje vodonika i kiseonika, dakle voda se može smatrati hidridom kiseonika. Kiseonik pripada VIa grupi Periodnog sistema. Da bi se uvidelo koliko je tačka ključanja vode visoka, treba je uporediti sa temperaturama na kojima ključaju hidridi ostalih elemenata iz VIa grupe: H 2 S ključa na -62 o C, H 2 Se na -42 o C, dok tačka ključanja H 2 Te iznosi -2 o C . Hidrid kiseonika ključa na temperaturi koja je za oko sto sedamdeset stepeni viša od temperature koju bismo očekivali na osnovu tendencije u nizu sumpor-selen-telur! Ovo ukazuje da između molekula u vodi postoje privlačne sile koje su mnogo jače od onih u sličnim jedinjenjima drugih elemenata.
Visoka tačka topljenja
Tačka topljenja leda je, uzimajući u obzir hidride drugih elemenata VIa grupe, za najmanje sto stepeni viša od “očekivane”. H 2 S se mrzne na -83 o C , H 2 Se na -65 o C, a H 2 Te na -49 o C. Na osnovu analogije, tačku topljenja H 2 O procenili bismo na oko -100 o C.
Voda se prilikom hlađenja širi
Ogromna većina supstanci se prilikom zagrevanja širi, tj. smanjuje im se gustina. Obratno, prilikom hlađenja, gustina se povećava. To je slučaj i sa vodom, ali samo na temperaturama iznad 4 o C (tačnije: iznad 3,98 o C ). Na 4 o C gustina vode je maksimalna, da bi se hlađenjem ispod te temperature smanjivala.
Voda prilikom hlađenja postaje stišljivija
Ogromna većina tečnosti prilikom zagrevanja se sve manje opire promeni zapremine, to jest njihova kompresibilnost (stišljivost) raste. Obratno, prilikom hlađenja, kompresibilnost se smanjuje. U slučaju vode, kompresibilnost se usled hlađenja smanjuje samo u intervalu od 100 o C do 46 o C dok se daljim hlađenjem povećava .
Toplotni kapacitet vode ima minimum
Minimalni toplotni kapacitet vode je na 35 o C, a raste i prilikom zagrevanja i prilikom hlađenja.
Druge anomalije vode
Uočene su i brojne druge “anomalije”, koju vodu razlikuju od velike vecine drugih tečnosti. Zainteresovane čitaoce upućujemo na sajt www.lsbu.ac.uk/water/anmlies.html , gde je nabrojano čak četrdeset takvih osobina.
Molekul vode ima oblik trougla, a veza H-O-H obrazuje ugao od 104,5 o . Zbog elektronegativnosti kiseonika, elektronski oblak je pomeren prema atomu kiseonika, tako da je on negativno naelektrisan. Atomi vodonika su pozitivno naelektrisani, a ceo molekul vode ima znatan diploni momenat (1,88 D), što dovodi do privlačenja između molekula vode. Međutim, mnogo jače vezivanje između molekula nastaje usled vodonične veze .
Vodonična veza je vrsta slabe hemijske veze koja se uspostavlja između vodonikovog atoma vezanog za neki elektronegativni atom i nekog drugog elektronegativnog atoma. U slučaju vode, vodonična veza je oblika H–O–H- - -OH 2 , dakle povezuje dva molekula H 2 O u dimere (H 2 O ) 2 . Ovakvi dimeri eksperimentalno su dokazani jošu u sedamdesetim godinama prošlog veka. Međutim, stvarna struktura vode je mnogo složenija jer vezivanje preko vodoničnih veza może obuhvatiti veći broj molekula H 2 O pri čemu nastaju čestice formule (H 2 O) n sa n=3,4,5 ,... pa čak i n=280.
Sistemi oblika (H 2 O ) n u literaturi se nazivaju “klasteri”. Broj mogućih klastera oblika (H 2 O ) n je veoma velik, i može se odrediti metodama teorije grafova. Na primer za n = 8 broj klastera je 164461.
Ekperimentalni rezultati
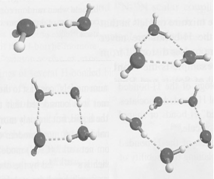 Eksperimentalnu tehniku za dokazivanje i određivanje strukture klastera koji su prisutni u vodi razradio je Sajkali sa saradnicima, devedesetih godina prošlog veka. Tehnika koja se za tu svrhu primenjuje koristi lasere u dalekoj infracrvenoj oblasti i naziva se vibraciono-rotaciono-tunelirajuća spektroskopija ( FIR-VRT, Far-infrared vibration-rotation-tunneling spectroscopy ). Analizom fine strukture dobijenih spektara moguće je ustanoviti ne samo postojanje nekih klastera već i njihov geometrijski oblik. Eksperimentalnu tehniku za dokazivanje i određivanje strukture klastera koji su prisutni u vodi razradio je Sajkali sa saradnicima, devedesetih godina prošlog veka. Tehnika koja se za tu svrhu primenjuje koristi lasere u dalekoj infracrvenoj oblasti i naziva se vibraciono-rotaciono-tunelirajuća spektroskopija ( FIR-VRT, Far-infrared vibration-rotation-tunneling spectroscopy ). Analizom fine strukture dobijenih spektara moguće je ustanoviti ne samo postojanje nekih klastera već i njihov geometrijski oblik.
Osnovni rezultati su sledeći: u vodi postoje trimeri (n=3), tetrameri (n=4 ) i pentameri (n=5 ), i ovi klasteri su planarni, oblika trougla, četvorougla, odnosno petougla. Dokazano je postojanje i heksamera (n=6) za koji eksperimentalni rezultati ukazuju da nije planaran, nema oblik šestougaonika, nego ima složeniju, kavezastu strukturu. Dokazano je da u vodi postoje i klasteri sa n=7,8,9,10 ali o nihovoj konkretnoj geometrijskoj strukturi sada se ne bi moglo govoriti.
Teorijski rezultati
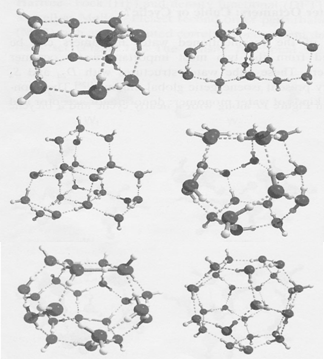 Istraživanje klastera vode metodama kvantne hemije veoma je aktivno područje teorijske hemije, i na tu temu je objavljen veliki broj radova. Najtačniji proračuni su, iz razumljivih razloga, vršeni na malim klasterima. Za klastere sa n=3,4,5 teorijski rezultati se u potpunosti slažu sa eksperimentalnim. U slučaju heksamera, došlo se do otkrića da postoji čak pet različitih geometrijskih rasporeda šest, vodoničnim vezama povezanih, molekula H 2 O , koji imaju istu energiju. Ovi klasteri su prikazani na slici 2; srednji klaster u drugom redu je onaj za koji se, na osnovu eksperimentalnih podataka, tvrdi da je jedini heksamer koji postoji u vodi. Istraživanje klastera vode metodama kvantne hemije veoma je aktivno područje teorijske hemije, i na tu temu je objavljen veliki broj radova. Najtačniji proračuni su, iz razumljivih razloga, vršeni na malim klasterima. Za klastere sa n=3,4,5 teorijski rezultati se u potpunosti slažu sa eksperimentalnim. U slučaju heksamera, došlo se do otkrića da postoji čak pet različitih geometrijskih rasporeda šest, vodoničnim vezama povezanih, molekula H 2 O , koji imaju istu energiju. Ovi klasteri su prikazani na slici 2; srednji klaster u drugom redu je onaj za koji se, na osnovu eksperimentalnih podataka, tvrdi da je jedini heksamer koji postoji u vodi.
Modeli strukture tečne vode
Na osnovu do sada sakupljenih eksperimentalni i teorijskih rezultata, jasno je da u tečnoj vodi slobodnih molekula H 2 O ili uopšte nema ili su prisutni u ništavnoj količini. Drugim rečima, voda nema formulu H 2 O. Šta voda jeste, odnosno kakve se specije u njoj nalaze, malo je teže reći. Predložen je veći broj različitih teorijskih modela za vodu. Ovi modeli imaju zadatak da, ako ne kvantitativno, onda makar kvalitativno objasne sve pojave koje smo nazvali “anomalnim ponašanjem” vode. Do sada u tome nijedna teorija nije u potpunosti uspela, mada svaka od njih rešava jedan deo problema.
Model koji je nedavno predložio Vajnhold (Weinhold) pretpostavlja da se u vodi istovremeno, u dinamičkoj ravnoteži, nalaze svi mogući klasteri. Pri tome (prema Bolcmanovom zakonu), što je klaster nestabilniji, tj. što ima višu energiju, to je njegova količina manja. Ovi klasteri bi se stalno stvarali i razgrađivali, a količina svakog pojedinačnog klastera menjala bi se sa temperaturom. Vajnhold je svoju teoriju nazvao QCE model ( quantum cluster equilibrium model ) .
Jedan mnogo bizarniji model predložio je Čaplin ( Chaplin ). Prema njemu, osnovni strukturni motiv u vodi je klaster sa 280 molekula H 2 O spojenih (vodoničnim vezama) u trodimenzionalnu mrežu koja ima oblik pravilnog ikosaedra. Usled toplotnog kretanja ovaj rapored bi se stano urušavao i ponovo stvarao, ali prema Čaplinovoj teoriji - voda koju pijemo ima formulu (H 2 O ) 280 .
Nama se model QCE čini prihvatljivijim. Prema njemu, voda koju pijemo je smeša većeg broja jedinjenja formule (H 2 O ) n ; n=2,3,4,... a njen sastav se menja sa temperaturom. Ono čega u vodi koju pijemo sigurno nema - to je H 2 O!
Prof. dr Branislav Čabrić
Kompletni tekstove sa slikama i prilozima potražite u magazinu
"PLANETA" - štampano izdanje ili u ON LINE prodaji Elektronskog izdanja
|

